概要
drug2drugs
®は、標的タンパク質の情報を用いずに、一つの活性化合物の構造情報のみから、別の骨格の活性化合物を増やすサービスです。活性化合物を増やすことで、創薬研究の成功確率を高めます。
活性化合物とは、標的タンパク質への結合力を有する化合物のことです。多様な骨格を持つ活性化合物を複数持つことが、毒性・物性・特許性などの観点で、創薬研究の成功確率向上には重要です。
富士フイルムは、一つの活性化合物を基点に別骨格の活性化合物を増やすことを目的に、AIとシミュレーションに基づく新しい骨格変換の手法であるAI-AAM
® (AI-Amino-Acid Mapping) を開発しました。AI-AAM
®での骨格変換には、活性化合物の構造情報のみ必要で、標的タンパク質の情報が不要です。
この度、AI-AAM
®の骨格変換によって、低分子・ペプチドの活性化合物を基点に、活性化合物を増やすサービスdrug2drugsを開始致します。
サービスの特長
- 新たな医薬品候補化合物を独自AIを活用しデザインする、「探索・設計シミュレーション技術を用いた創薬支援サービス」です。
- 既存の化合物ライブラリーからの探索のみならず、従来発想できなかった新規化合物の設計も可能です。
- 膨大な時間がかかっていた新薬開発の期間短縮や、コストダウン、成功率向上に大きく貢献します。
- AI-AAM®での骨格変換には、活性化合物の構造情報のみ必要で、標的タンパク質の情報が不要です。
AI-AAMでの活性化合物の増やし方(fig.1)
AI-AAMを構成するAAM記述子と構造式生成AIについて
1. AAM (Amino-Acid Mapping) 記述子[1](
fig.2)
AAM記述子とは、化合物周辺における各アミノ酸残基20種の存在確率(3D分布のセット)のことを表し、化合物のみから分子シミュレーションによって第一原理的に計算されます。化合物間の骨格が異なるにも関わらず、AAM記述子の類似度(=AAM類似度)が高い場合がありますが、この場合、AAM類似度の高い化合物は同じようにアミノ酸残基と相互作用し、その結果として、同じようにタンパク質と相互作用することが分かっています。活性化合物のAAM記述子は、化合物側から抽出した標的タンパク質の結合サイトを近似して表現しています。
2. 構造式生成AI[2](
fig.3)
構造式設計AIは、富士フイルムの材料開発の中で構築された独自技術です。構造式設計AIでは、高い熱安定性、合成適性を満たした、多様な化合物(構造式)を創出します。このAIとAAM記述子を組み合わせることで、基点の活性化合物とのAAM類似度が高い構造式を設計可能となります。即ち、構造式設計AIにより、同等のAAM記述子を持ち、かつ全く異なる骨格を持つ化合物が得られます。また、ゼロからの化合物設計だけでなく、基点化合物の置換基や母核など、骨格の一部を固定し、その他の部分を設計することも可能です。
[1]特許第06826672号、[2]特許第07191969号, 特許第07190498号, 特許第07116186号
AI-AAMを低分子・ペプチドの活性化合物に適用し、骨格変換した結果
1. 低分子から低分子への骨格変換[3](
fig.4)
SYK阻害剤BIIB-057の構造式を基点に、データベースの化合物約1,200万種の中から探索し、AAM記述子が最も類似した化合物としてXC608を抽出(探索時間は約1ヶ月)
2. ペプチドから低分子への骨格変換[4](
fig.5)
PDL1阻害剤Peptide-71の 結合配座および結合部位 *を基点に、新規構造を設計し、低分子化合物FF-ATC-001を取得 (設計時間は約1ヶ月)
* PDL1との結合時のPeptide-71の立体構造、およびPDL1と接触しているPeptide-71の部分
[3]CBI学会2022年大会P08-14、[4]CBI学会2022年大会P08-07, Excellent Poster Awards、[5]WO 2009/136995、 [6]WO 2011/035077、[7]US20140294898 A1
基本的なサービス内容と納品イメージ
サービス実施において、下記情報をご提供いただきます。
標的タンパク質の配列・三次元構造情報は不要です。
- 低分子(基点の活性化合物)→ 低分子(新規化合物)の場合:基点化合物の構造式
- ペプチド(基点の化合物)→ 低分子(新規化合物)の場合:基点ペプチドの結合配座と結合部位情報
お客様の課題に応じて、基点とする活性化合物をどの程度骨格変換するか(全体の骨格変換か、母核・側鎖を固定した部分変換か、など)も自由に設定が可能です。また、AI-AAM
®をその他の計算手法と組み合わせることで、必要な特性(溶解度、Ames試験に対する安全性、リピンスキーの法則の基準など)を持つ化合物の構造情報を提示することができます。設計した化合物は、構造情報での納品の他、合成経路の立案~予備検討~最終合成物のデータ提供までご提案が可能です(オプション)。

新規化合物は既存の化合物データベースから抽出する【探索】と、構造式設計AIによる【生成】いずれかの方法があります。
【納品イメージ】
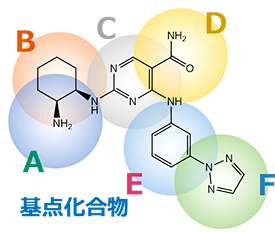 |
お客様からいただいた基点化合物をもとに、探索もしくは生成した新規化合物の構造情報と、それぞれのAAM類似度を併記して納品いたします。 構造式だけではなく、部分ごとのAAM類似度・基点化合物と三次元構造を重ね合わせた図も確認することで、どのような骨格変換がなされたかが分かり、お客様側で得られたアッセイ結果と併せて、SARの取得に活用することが可能です。 |

